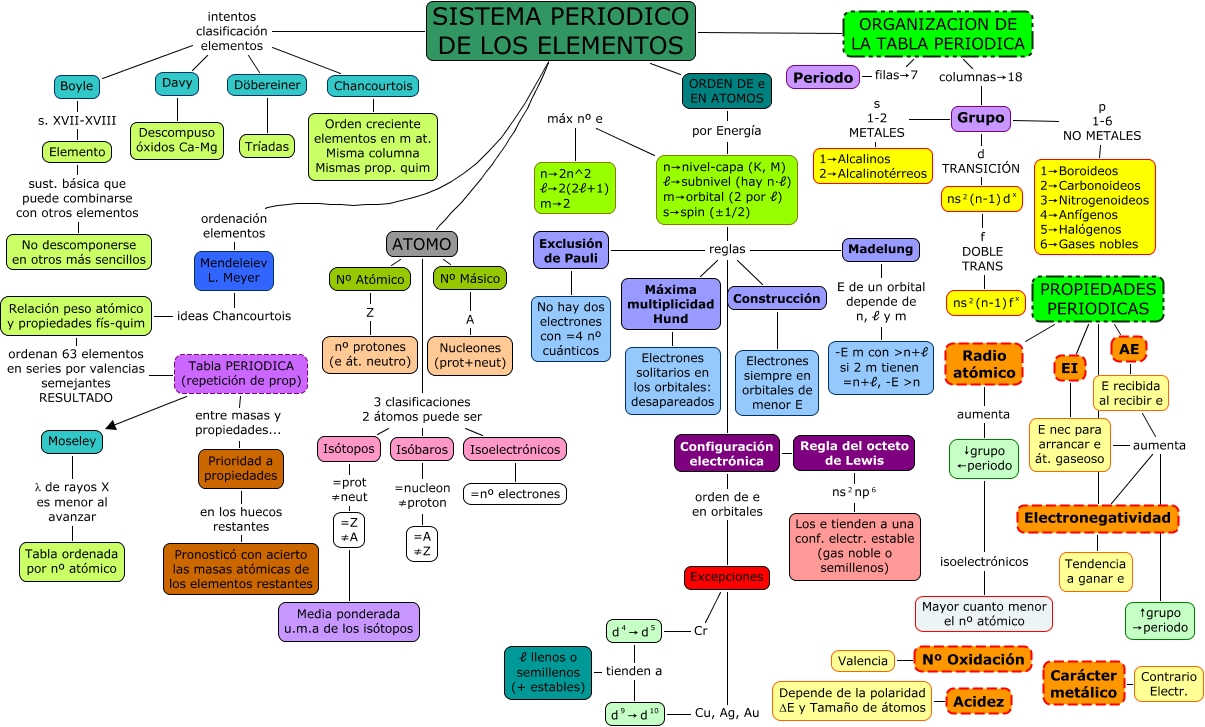
Son propiedades que presentan los elementos químicos y que se repiten secuencialmente en la tabla periódica. Por la colocación en la misma de un elemento, podemos deducir que valores presentan dichas propiedades así como su comportamiento químico.
* Su estudio en la tabla
Tal y como hemos dicho, vamos a encontrar una periodicidad de esas
propiedades en la tabla. esto supone, por ejemplo, que la variación de
una de ellas en los grupos va a responder a una regla general. Esto nos
permite, al conocer estas reglas de variación, cual va a ser el
comportamiento químico de un elemento, ya que dicho comportamiento,
depende en gran manera, de sus propiedades periódicas.
* Principales propiedades periódicas
Hay un gran número de propiedades periódicas. Entre las más importantes destacaríamos:
- Estructura electrónica: distribución de los electrones en los orbitales del átomo
- Potencial de ionización: energía necesaria para arrancarle un electrón.
- Electronegatividad: mide la tendencia para atraer electrones.
- Afinidad electrónica: energía liberada al captar un electrón.
- Carácter metálico: define su comportamiento metálico o no metálico.
- Valencia iónica: número de electrones que necesita ganar o perder para el octete.
* Otras propiedades periódicas
Podemos enumerar
- Volumen atómico - Radio iónico - Radio atómico
- Densidad - Calor específico - Calor de vaporización
- Punto de ebullición - Punto de fusión - Valencia covalente
Radio
Atómico: Está
definido como mitad de la distancia entre dos núcleos de dos átomos
adyacentes diferentes propiedades físicas densidad punto de fusión
punto de ebullición esta están relacionados con el tamaño de los
átomos
- Se caracterizan en gran medida por la fuertemente atracción entre el núcleo sobre los electrones
- Cuenta mayor carga nuclear los electrones estarán más fuertemente enlazados al núcleo y menor será el radio atómico
Energía
de Ionización:
Se define como la cantidad mínima de energía que hay que
suministrar a un átomo neutro gaseoso y en estado fundamental para
arrancarle el e- enlazado con menor fuerza es decir, mide la fuerza
con la que está unido el e- al átomo
- Es una energía muy elevada para los gases nobles y es necesaria una mayor cantidad de energía
- Las energías de ionización pequeña indican que los e- se arrancan con facilidad
Afinidad
Electrónica: Es
la energía intercambiada cuando un átomo neutro gaseoso y en su
estado fundamental capta un electrón y se convierte en un ion mono
negativo es la cantidad de energía absorbida por un átomo aislado
en fase gaseosa para formar un ion con una carga electrónica de -1
si la energía no es absorbida sino liberada en el proceso tendrá en
conciencia valor negativo tal y como sucede para la mayoría de los
elementos químicos.
Electronegatividad:
Es la propiedad que explica el tipo de enlace químico en un
compuesto y las propiedades de reacción de estos se puede definir
como capacidad que tiene un elemento para atraer electrones o
densidad electrónica cuando forma un enlace. Hace referencia a la
nube atómica que abarca todo el compuesto, esta propiedad obtiene
valores arbitrarios aumenta a medida que se avanza en un periodo y
que disminuye a medida que se baja en un grupo.
Electropositividad: Es la tendencia de un átomo o molécula de un elemento a ceder electrones.Formalmente la electropositividad es el concepto opuesto a la electronegatividad ya que los elementos electronegativos son aquellos que tienden a atraer electrones.
.png)





.jpg)



